N'hésitez pas à faire tourner la molécule (cliquez et glissez le curseur souris), à zoomer (appuyez sur majuscule et glissez le curseur souris de bas en haut ou utilisez la molette de défilement).
Vue: classique
Soyez patient avec les grosses molécules...
Par défaut un clic sur un atome n'a pas de conséquence, il faut activer le "picking":
set picking on, off.Enregistrer le fichier (pour les fichiers proposés et chargés depuis le serveur
didac-tic.fr).L'Hémoglobine ↑
Si la molécule n'est pas déjà chargée, vous pouvez cliquer ici.Structure de la molécule
Dans l'espèce humaine existent plusieurs hémoglobines; la plus courante chez l'adulte (HbA) est constituées de 4 chaines protéiques: 2 chaines α (alpha) et deux chaines β (bêta). Chaque chaine est associée à un groupe non protéique, l'hème.L'hème contient en son centre un atome de fer Fe2+ relié à 4 atomes d'azote.
Les commandes globales présentes en haut de page seront utiles pour mettre ces trois éléments en évidence, mais pour distinguer ces trois éléments, on les sélectionne successivement en leur appliquant une coloration ou un choix de visualisation spécifique.
Affiche le squelette d'une protéine ou d'un acide nucléique en reliant les carbones α. Le carbone α des acides aminés est celui qui participe à la liaison peptidique. Le carbone α dans les acides nucléiques est le carbone 1' du sucre (ribose ou désoxyribose). La commande
trace a un effet presque identique à backbone en plus lissé. La cohérence de la visualisation demande de régler spacefill et surtout wireframe à 0.Permet une simplification de l'affichage de la partie protéique de la molécule.
cartoon on s'associe bien avec une coloration par chaine (ci-après). La cohérence de la visualisation demande de régler spacefill et surtout wireframe à 0.select {nom ou code}; les noms ou codes désignant une portion de molécule; on rappelle que la commande select n'ayant pas d'effet visible immédiat, il faut on affecter ensuite une couleur ou une visualisation particulière à l'élément selectionné. Une bonne précaution en fin de commande select est de sélectionner à nouveau toute la molécule: (select *) pour éviter des surprises avec les commandes ultérieures.color {nom ou code}; les noms ou codes de couleurs: color cpk (Corey / Pauling / Kultun) est la coloration par défaut, ce qui donne: C H N O S P. En visualisation
cartoon tous les atomes sont représentés en gris.select protein; color chain; select *: on limite la coloration aux chaines protéiques. color amino colorie différement les différents acides aminés, moins intéressante ici que la coloration différenciée des chaines.
select hem; wireframe 0.4; select *
select *.fe; spacefill 60%; select *: sélectionne les atomes de fer (si les atomes courants sont désignés par leur initiale, le fer demande 2 lettres.
Résumé des commandes précédentes.
Transport de l'oxygène
La fonction de l'hémoglobine est de transporter l'oxygène. La forme oxydée est modélisée par un autre fichier à télécharger à la place du précédent et on peut lui appliquer les mêmes commandes.Pour visualiser la molécule de dioxygène transportée, il faut la sélectionner et lui attribuer une visualisation spécifique (ce dioxygène étant caché à l'arrière, faites tourner la molécule ou cliquez ici).
Une molécule de dioxygène peut se fixer par liaisons covalentes temporaires, d'une part au fer, d'autre part à l'atome d'hydrogène de l'histidine proche (en position 87); cette fixation déforme la molécule d'hémoglobine.
Visualiser l'histidine 87.
Charger simultanément les deux modèles pour les afficher en alternance (pour faire tourner la molécule vous pouvez cliquez ici):
Ici une seule chaine d'Hémoglobine porte une molécule de dioxygène; la déformation précédente favorise la fixation de l'oxygène sur les autres hèmes de la même molécule (la courbe de la saturation en oxygène d'une solution d'hémoglobine en fonction de la pression partielle d'oxygène est une sigmoïde). Cette coopération permise par la structure tétramèrique constitue un avantage évolutif. La structure en tétramère est commune à tous les Vertébrés.
Les modèles utilisés sont ceux de la page "Molecule of the month" citée ci-dessous. Certains éléments des scripts sont repris de la même page (auteur: Belle Lin).
2003. Hemoglobin. Molecule of the month (Pdb101). DOI: 10.2210/rcsb_pdb/mom_2003_5. Les stades oxygéné et désoxygéné (JSmol).
David Marcey. 2021. Hemoglobin A Structure, Sickle Cell Anemia, and Carbon Monoxide Toxicity (JSmol).
David Marcey. 2021. Hemoglobin A Structure, Sickle Cell Anemia, and Carbon Monoxide Toxicity (JSmol).
L'évolution des globines ↑
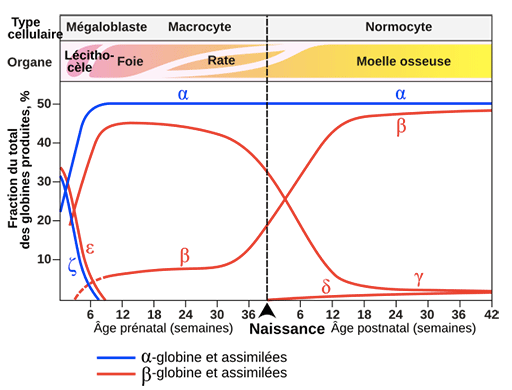
Comme on l'a vu plus haut l'hémoglobine la plus fréquente chez l'humain adulte (HbA) est constituée de 4 chaines protéiques: 2 chaines α (alpha) (gènes sur le chromosome 11) et deux chaines β (bêta). Chez le foetus (HbF) les deux chaines β (bêta) sont remplacées par des chaines γ (gamma) (gènes sur le chromosome 16). La myoglobine est une molécule de la même famille dont la fonction est de stocker le dioxygène au niveau des muscles (le gène de la myoglobine est sur le chromosome 22). Chez les Amphibiens, comme le Xenopus, ou chez des poissons, comme Danio rerio (Zebra fish), ces deux types de gènes sont localisés sur un même chromosome.
Le changement d'activité des gènes concernés se fait en quelques semaines autour de la naissance et les cellules concernées sont celles de la moelle osseuse des os longs pour l'adulte et les cellules du sac vitellin et du foie puis de la rate chez le fœtus. L'hémoglobine transporte 70 fois plus de dioxygène que la même masse de plasma. HbF a une plus forte activité pour le dioxygène que HbA, ce qui permet le transfert du dioxygène à travers le placenta.
Il existe en réalité une série de gènes de globine de séquence voisine, voire identique, résultant de duplications et groupés en clusters. Au sein d’un cluster, les gènes sont activés successivement aux différentes périodes de la vie, sous le contrôle d’un locus régulateur.
En 1962, Perutz et Kendrew ont été récompensés par le prix Nobel de chimie pour avoir élucidé, par diffraction des rayons X, les structures spatiales de l'hémoglobine et de la myoglobine.
Evolution des globines humaines: la commande qui suit charge l'hémoglobine fœtale (HBF) limitée à sa chaine G (chaine γ), une chaine α de l'hémoglobine HBA et une chaine β de la même hémoglobine HBA. Les chaines ont été alignées en 3D grâce au site
www.rcsb.org/alignment. Chargez tout.
On ajoute la commande frame all pour afficher les trois modèles simultanément. La suite de commandes: cartoon on; wireframe 0; spacefill 0%; color chain; permet un affichage facilitant la distinction entre les 3 modèles. Alternativement l'affichage limité au squelette et la coloration différenciée des acides aminés est tout aussi intéressante que l'affichage en effigie (cartoon); les commandes sont présentes en haut de page; frame 1.1 affiche le premier modèle chargé (chaine gamma), frame 2.1 affiche la chaine alpha , frame 3.1 affiche la chaine beta.
select 1.1 and hem; wireframe 0.4; color cpk; select 1.1 and *.fe; spacefill 60%; frame 1; select *: pour afficher l'hème (du premier modèle (chaine γ).
show sequence affiche la séquence (par défaut dans la console, ici dans une fenêtre d'alerte).Pour confronter la comparaison spatiale et celle des séquences, vous pouvez aligner les séquences avec le logiciel adéquat.
Evolution de la chaine α (alpha) ↑
La commande qui suit charge les chaines alpha des hémoglobines de 4 espèces: la Myxine, la Lamproie, la Truite et l'Humain. Les chaines ont été alignées en 3D grâce au sitewww.rcsb.org/alignment. Cette séquence est inspirée de la Librairie de molécules, toutefois les fichiers utiliisés sont différents.Chargez tout.
Cliquez ici pour optimiser l'affichage. Comme précédemment vous pouvez utiliser d'autres visualisations.
Les cases à cocher permettent de choisir quels sont les modèles affichés;
Cliquez pour charger les séquences d'acides aminés (non alignées).
2017. Globin Evolution. DOI: http://doi.org/10.2210/rcsb_pdb/mom_2017_2. Molecule of the month (Pdb101).
David Goodsell. 2000. Myoglobin. DOI: doi.org/10.2210/rcsb_pdb/mom_2000_1. Molecule of the month (Pdb101).
AS. Pillai et al.. 2020. Origin of complexity in haemoglobin evolution. Nature 581(7809): 480-485. DOI: 10.1038/s41586-020-2292-y; erratum: Nature. 2020 Jul;583(7816):E26 DOI: 10.1038/s41586-020-2472-9
bac ES 2006 Amérique du nord, thème au choix: place de l'Homme dans l'évolution.
Comparaison des gènes des globines humaines.
Jacques Barrère. . La famille multigénique des globines. INRP ACCES.
Henri Wajcman Laurent Kiger. 2022. L’hémoglobine, des micro-organismes à l’homme : un motif structural unique, des fonctions multiples . Académie des sciences. Comptes Rendus. Biologies, Volume 325 (2002) no. 12, pp. 1159-1174.
David Goodsell. 2000. Myoglobin. DOI: doi.org/10.2210/rcsb_pdb/mom_2000_1. Molecule of the month (Pdb101).
AS. Pillai et al.. 2020. Origin of complexity in haemoglobin evolution. Nature 581(7809): 480-485. DOI: 10.1038/s41586-020-2292-y; erratum: Nature. 2020 Jul;583(7816):E26 DOI: 10.1038/s41586-020-2472-9
bac ES 2006 Amérique du nord, thème au choix: place de l'Homme dans l'évolution.
Comparaison des gènes des globines humaines.
Jacques Barrère. . La famille multigénique des globines. INRP ACCES.
Henri Wajcman Laurent Kiger. 2022. L’hémoglobine, des micro-organismes à l’homme : un motif structural unique, des fonctions multiples . Académie des sciences. Comptes Rendus. Biologies, Volume 325 (2002) no. 12, pp. 1159-1174.
Bibliographie
Duane W. Sears. Script guide. University of California Santa Barbara.
Une référence du langage de commande plus accessible que la page d'aide officielle (mais moins complète).
Une référence du langage de commande plus accessible que la page d'aide officielle (mais moins complète).
Adresse de cette page: http://www.didac-tic.fr/pdb/globins.php